May -Akda:
Lewis Jackson
Petsa Ng Paglikha:
5 Mayo 2021
I -Update Ang Petsa:
1 Hulyo 2024

Nilalaman
Ang Mol ay ang karaniwang yunit ng pagsukat sa kimika, ginamit upang tingnan ang iba't ibang mga elemento sa isang compound. Kadalasan ang compound mass ay kinakalkula sa gramo (g) at kailangang i-convert sa mga molar unit. Ang paglipat ay medyo simple, subalit, mayroon pa ring ilang mahahalagang hakbang na kailangan nating sundin. Gamit ang pamamaraan sa ibaba, madali mong mai-convert ang gramo sa mga moles.
Mga hakbang
Bahagi 1 ng 2: Kalkulahin ang mass ng molekula
Ihanda ang mga kinakailangang supply upang malutas ang problema sa matematika. Kapag mayroon ka ng lahat ng mga tool na magagamit, mas madali itong malulutas ang problema. Ang kailangan mo ay:
- Lapis at papel. Nagiging madali ang matematika kapag isinulat mo ang lahat sa papel. Kailangan mong ipakita ang lahat ng mga hakbang upang makamit ang maximum na iskor.
- Panahon ng talahanayan ng mga elemento ng kemikal: ginamit upang matukoy ang mga atomo ng masa ng mga elemento.
- Pocket calculator: ginamit upang makalkula ang mga kumplikadong numero.

Tukuyin kung aling mga elemento ang nasa compound na kailangan mo upang mai-convert sa mga yunit ng molar. Ang unang hakbang sa pagkalkula ng mass ng molekular ay upang matukoy ang mga elemento na bumubuo sa compound. Madali ito sapagkat ang pagpapaikli para sa mga elemento ay isa hanggang dalawang character lamang.- Kung ang isang sangkap ay pinaikling ng dalawang titik, ang unang titik ay gagamitin ng malaking titik at ang pangalawang titik ay maliit. Halimbawa: Ang Mg ay ang pagpapaikli para sa elementong magnesiyo.
- Mga compound ng NaHCO3 binubuo ng apat na elemento: sodium (Na), hydrogen (H), carbon (C) at oxygen (O).
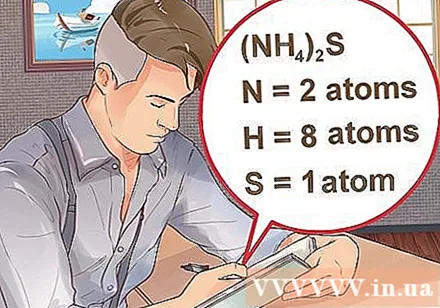
Tukuyin ang bilang ng mga atom para sa bawat elemento sa compound. Kailangan mong malaman ang bilang ng atomiko ng bawat sangkap sa isang compound upang makalkula ang mass Molekyul ng compound na iyon. Ang maliit na numero sa tabi ng pagdadaglat ng elemento ay kumakatawan sa numero ng atomic ng elemento.- Halimbawa: tambalang H2Ang O ay mayroong dalawang hydrogen atoms at isang oxygen atom.
- Kung ang isang compound ay nakasulat sa panaklong, na sinusundan ng isang maliit na index, ang bawat sangkap sa panaklong ay nagpaparami ng index. Halimbawa: tambalan (NH4)2Ang S ay binubuo ng dalawang N atoms, walong H atoms at isang S atom.

Isulat ang cubic atomic paper para sa bawat elemento. Ang paggamit ng periodic table ay ang pinakamadaling paraan upang makahanap ng cubic atom ng isang elemento. Matapos mong hanapin ang elemento sa periodic table, makikita mo ang atomic mass sa ibaba lamang ng icon ng elemento.- Halimbawa, ang cubic atom ng oxygen ay 15.99.
Kalkulahin ang mass ng molekula. Ang mass Molekyul ng isang sangkap ay katumbas ng bilang ng mga atom ng bawat elemento na pinarami ng mass atom ng elementong iyon. Ang dami na ito ay mahalaga sa gramo hanggang molar conversion.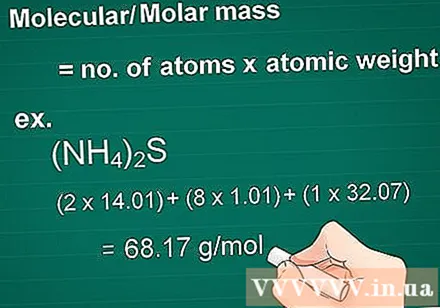
- Una, paramihin ang bilang ng atomiko ng bawat elemento sa tambalan sa pamamagitan ng mass atom nito.
- Pagkatapos, idagdag magkasama ang mga masa ng mga elemento sa compound.
- Halimbawa: Molekular na masa ng isang compound (NH4)2S = (2 x 14.01) + (8 x 1.01) + (1 x 32.07) = 68.17 g / mol.
- Ang masa ng molekular ay kilala rin bilang masa ng molar.
Bahagi 2 ng 2: Gawing mol ang gramo
I-set up ang formula ng conversion. Upang makita ang bilang ng mga moles ng compound, hatiin ang bilang ng gramo ng tambalan ng molar mass ng compound na iyon.
- Formula: bilang ng mga moles = mass (gramo) / molar mass ng compound (gram / mol)
Palitan ang mga numero sa pormula. Matapos i-set up ang tamang pormula, ang susunod na hakbang ay upang palitan ang mga numero na iyong nakalkula sa formula. Kung nais mong tiyakin na ang data ay nasa tamang posisyon, maaari mo itong suriin sa pamamagitan ng pagpigil sa yunit. Kung pagkatapos ng pagiging simple ang natitirang yunit ay moles pagkatapos ay itinakda ka nang tama.
Malutas ang equation. Gamit ang isang calculator, hatiin ang masa sa cubic Molekyul ng sangkap o compound. Ang quienty ay ang bilang ng mga moles ng sangkap o compound na iyong hinahanap.
- Halimbawa, ang problema ay para sa 2 g ng tubig (H2O) at hilingin sa iyo na i-convert ito sa mga yunit ng molar. Mayroon kaming molar mass ng H2Ang O ay 18g / mol. Hatiin ang 2 sa 18, kaya mayroon kang 0.1111 mol H2O.
Payo
- Huwag kalimutang isama ang elemento o pangalan ng tambalan sa mga sagot.
- Kung hiniling sa iyo na magpakita ng isang ehersisyo o pagsusulit, tiyaking ipinapakita mo ang iyong mga sagot nang malinaw sa pamamagitan ng pag-ikot o pagguhit ng isang kahon sa paligid ng mga sagot.
Ang iyong kailangan
- Talaan ng periodic ng kemikal
- Lapis
- Papel
- Computer
- Mga problema sa kimika