May -Akda:
Carl Weaver
Petsa Ng Paglikha:
22 Pebrero 2021
I -Update Ang Petsa:
1 Hulyo 2024
Nilalaman
- Mga hakbang
- Paraan 1 ng 2: Kalkulahin ang koepisyent ng pagsipsip ng molar gamit ang formula
- Paraan 2 ng 2: Paghahanap ng grapiko ng Molar Absorption Coefficient
- Karagdagang mga artikulo
Ang koepisyent ng pagsipsip ng molar, na kilala rin bilang koepisyent ng pagkalipol ng molar, ay isang sukat kung gaano kalakas ang mga kemikal na mga particle (mga molekula) ng isang sangkap na sumipsip ng ilaw sa isang tukoy na haba ng daluyong. Ang bawat sangkap ay nailalarawan sa pamamagitan ng sarili nitong koepisyent ng pagsipsip ng molar, na kung saan ay malaya sa konsentrasyon at dami. Ang katangiang ito ay malawakang ginagamit sa kimika at hindi dapat malito sa koepisyent ng pagkalipol, na mas karaniwang ginagamit sa pisika. Ang pamantayan ng yunit ng sukat para sa pagsipsip ng molar ay litro na hinati ng taling at per centimeter (L mol cm).
Mga hakbang
Paraan 1 ng 2: Kalkulahin ang koepisyent ng pagsipsip ng molar gamit ang formula
 1 Suriin ang batas ng Bouguer-Lambert-Beer:A = ɛlc... Ang pagsipsip ng ilaw sa isang daluyan ay inilarawan ng equation A = ɛlc, saan A - ang dami ng ilaw ng isang tiyak na haba ng daluyong na hinihigop ng sample, ɛ - koepisyent ng pagsipsip ng molar, l ay ang distansya na nilakbay ng ilaw sa solusyon, at c - ang konsentrasyon ng solusyon (ang bilang ng mga pinag-aralan na mga molekula bawat dami ng yunit).
1 Suriin ang batas ng Bouguer-Lambert-Beer:A = ɛlc... Ang pagsipsip ng ilaw sa isang daluyan ay inilarawan ng equation A = ɛlc, saan A - ang dami ng ilaw ng isang tiyak na haba ng daluyong na hinihigop ng sample, ɛ - koepisyent ng pagsipsip ng molar, l ay ang distansya na nilakbay ng ilaw sa solusyon, at c - ang konsentrasyon ng solusyon (ang bilang ng mga pinag-aralan na mga molekula bawat dami ng yunit). - Ang koepisyent ng pagsipsip ay maaari ding matagpuan mula sa ratio sa pagitan ng mga kasidhian ng ilaw na nakukuha sa pamantayan at sample na pinag-aaralan. Sa kasong ito, ang equation ay ang mga sumusunod: A = log10(Akoo/ Ako).
- Natutukoy ang intensity ng ilaw gamit ang isang spectrophotometer.
- Ang kapasidad ng pagsipsip ng isang solusyon ay nakasalalay sa haba ng daluyong ng ilaw na dumadaan dito. Sa ilang mga halaga ng haba ng daluyong, ang ilaw ay mas malakas na hinihigop kaysa sa iba, at ang mga halagang ito ay nakasalalay sa komposisyon ng solusyon. Kapag nagkakalkula, huwag kalimutang ipahiwatig para sa kung anong paggawa ng haba ng daluyong ang mga ito ay ginawa.
 2 I-convert ang batas ng Bouguer-Lambert-Beer upang maipahayag ang koepisyent ng pagsipsip ng molar. Hatiin ang magkabilang panig ng equation ng haba at konsentrasyon, at ang resulta ay isang expression para sa koepisyent ng pagsipsip ng molar: ɛ = A / lc... Gamit ang formula na ito, maaari mong kalkulahin ang koepisyent ng pagsipsip ng molar para sa isang tukoy na haba ng daluyong.
2 I-convert ang batas ng Bouguer-Lambert-Beer upang maipahayag ang koepisyent ng pagsipsip ng molar. Hatiin ang magkabilang panig ng equation ng haba at konsentrasyon, at ang resulta ay isang expression para sa koepisyent ng pagsipsip ng molar: ɛ = A / lc... Gamit ang formula na ito, maaari mong kalkulahin ang koepisyent ng pagsipsip ng molar para sa isang tukoy na haba ng daluyong. - Ang kapasidad ng pagsipsip sa isang nakapirming distansya ay nakasalalay sa konsentrasyon ng solusyon at ang hugis ng ginamit na lalagyan. Tinatanggal ng koepisyentong pagsipsip ng molar ang mga kadahilanang ito.
 3 Sukatin ang mga kinakailangang halaga gamit ang spectrophotometry. Sa isang spectrophotometer, ang ilaw na may isang tukoy na haba ng daluyong ay ipinapasa sa pamamagitan ng isang sangkap, at ang kasidhian ng inilipat na ilaw ay sinusukat sa output. Ang bahagi ng ilaw ay hinihigop ng solusyon at ang lakas ng ilaw ay bumababa. Sinusukat ng spectrophotometer ang tindi ng nailipat na ilaw, na ginagamit upang makalkula ang koepisyent ng pagsipsip ng molar.
3 Sukatin ang mga kinakailangang halaga gamit ang spectrophotometry. Sa isang spectrophotometer, ang ilaw na may isang tukoy na haba ng daluyong ay ipinapasa sa pamamagitan ng isang sangkap, at ang kasidhian ng inilipat na ilaw ay sinusukat sa output. Ang bahagi ng ilaw ay hinihigop ng solusyon at ang lakas ng ilaw ay bumababa. Sinusukat ng spectrophotometer ang tindi ng nailipat na ilaw, na ginagamit upang makalkula ang koepisyent ng pagsipsip ng molar. - Maghanda ng isang solusyon ng kilalang konsentrasyon para sa pagtatasa c... Tukuyin ang konsentrasyon sa mga yunit ng mol / gramo o mol / litro.
- Para sa pagtukoy l sukatin ang haba ng ginamit na cuvette. Isulat ang haba sa sentimetro.
- Sukatin ang pagsipsip sa isang spectrophotometer A para sa isang tukoy na haba ng daluyong. Ang haba ng haba ng haba ay sinusukat sa metro, ngunit ang ilaw ay masyadong maikli na karaniwang ipinapakita sa mga nanometers (nm). Ang kapasidad ng pagsipsip ay walang sukat.
 4 I-plug ang mga numero sa equation at hanapin ang molar coefficient ng pagsipsip. Kumuha ng mga halagang bilang A, c at l at isaksak ang mga ito sa formula ɛ = A / lc... Paramihan l sa cat pagkatapos hatiin A sa pamamagitan ng halagang ito upang makita ang koepisyent ng pagsipsip ng molar.
4 I-plug ang mga numero sa equation at hanapin ang molar coefficient ng pagsipsip. Kumuha ng mga halagang bilang A, c at l at isaksak ang mga ito sa formula ɛ = A / lc... Paramihan l sa cat pagkatapos hatiin A sa pamamagitan ng halagang ito upang makita ang koepisyent ng pagsipsip ng molar. - Ipagpalagay na sinusukat mo ang pagsipsip ng isang 0.05 mol / litro na solusyon gamit ang isang 1 cm cuvette. Sa kasong ito, ang pagsipsip ay 1.5 para sa ilaw na may haba ng haba ng 280 nm. Paano makahanap ng molar coefficient para sa isang naibigay na solusyon?
- ɛ280 = A / lc = 1.5 / (1 x 0.05) = 30 L mol cm
- Ipagpalagay na sinusukat mo ang pagsipsip ng isang 0.05 mol / litro na solusyon gamit ang isang 1 cm cuvette. Sa kasong ito, ang pagsipsip ay 1.5 para sa ilaw na may haba ng haba ng 280 nm. Paano makahanap ng molar coefficient para sa isang naibigay na solusyon?
Paraan 2 ng 2: Paghahanap ng grapiko ng Molar Absorption Coefficient
 1 Sukatin ang tindi ng ipinadala na ilaw para sa iba't ibang mga konsentrasyon ng solusyon. Maghanda ng 3-4 na solusyon na may iba't ibang konsentrasyon.Gamit ang isang spectrophotometer, sukatin ang pagsipsip ng mga solusyon ng iba't ibang mga konsentrasyon para sa isang naibigay na haba ng daluyong. Maaari kang magsimula sa pinakamababang solusyon sa konsentrasyon. Ang pagkakasunud-sunod ay hindi mahalaga, ang pangunahing bagay ay hindi upang malito at maitala ang sinusukat na mga halaga ng pagsipsip alinsunod sa mga konsentrasyon.
1 Sukatin ang tindi ng ipinadala na ilaw para sa iba't ibang mga konsentrasyon ng solusyon. Maghanda ng 3-4 na solusyon na may iba't ibang konsentrasyon.Gamit ang isang spectrophotometer, sukatin ang pagsipsip ng mga solusyon ng iba't ibang mga konsentrasyon para sa isang naibigay na haba ng daluyong. Maaari kang magsimula sa pinakamababang solusyon sa konsentrasyon. Ang pagkakasunud-sunod ay hindi mahalaga, ang pangunahing bagay ay hindi upang malito at maitala ang sinusukat na mga halaga ng pagsipsip alinsunod sa mga konsentrasyon.  2 I-plot ang mga nakuhang halaga sa grap. Plot konsentrasyon sa pahalang X-axis at pagsipsip sa patayong Y-axis, at isulat ang mga sukat bilang mga tuldok.
2 I-plot ang mga nakuhang halaga sa grap. Plot konsentrasyon sa pahalang X-axis at pagsipsip sa patayong Y-axis, at isulat ang mga sukat bilang mga tuldok. - Gumuhit ng isang linya sa pagitan ng mga puntos. Kung ang mga sukat ay isinagawa nang tama, ang mga puntos ay dapat na namamalagi sa isang tuwid na linya, yamang, ayon sa batas ng Bouguer-Lambert-Beer, ang kapasidad ng pagsipsip ay direktang proporsyonal sa konsentrasyon.
 3 Tukuyin dumidulas ng diretsopagdaan sa mga pang-eksperimentong puntos. Upang hanapin ang slope ng isang tuwid na linya, hatiin ang pagtaas ng Y ng pagtaas ng X abscissa. Kumuha ng dalawang puntos sa linya, ibawas ang mga kaukulang coordinate ng isang punto mula sa mga coordinate ng isa pa, at hatiin ang pagkakaiba ng Y ng X pagkakaiba.
3 Tukuyin dumidulas ng diretsopagdaan sa mga pang-eksperimentong puntos. Upang hanapin ang slope ng isang tuwid na linya, hatiin ang pagtaas ng Y ng pagtaas ng X abscissa. Kumuha ng dalawang puntos sa linya, ibawas ang mga kaukulang coordinate ng isang punto mula sa mga coordinate ng isa pa, at hatiin ang pagkakaiba ng Y ng X pagkakaiba. - Ang slope ng isang tuwid na linya (ang slope, o ang tangent ng slope) ay matatagpuan tulad ng sumusunod: (Y2 - Y1) / (X2 - X1). Sa kasong ito, ang puntong matatagpuan sa mas mataas kasama ang tuwid na linya ay itinalaga sa index 2, at sa mas mababang punto - ang index 1.
- Ipagpalagay, sa isang molar na konsentrasyon ng 0.2, ang pagsipsip ay 0.27, at sa isang konsentrasyon na 0.3, ito ay 0.41. Ang Absorbance ay naka-plot sa Y-axis at konsentrasyon sa X-axis. Gamit ang equation sa itaas, hanapin ang slope ng isang tuwid na linya: (Y2 - Y1) / (X2 - X1) = (0,41-0,27)/(0,3-0,2) = 0,14/0,1 = 1,4.
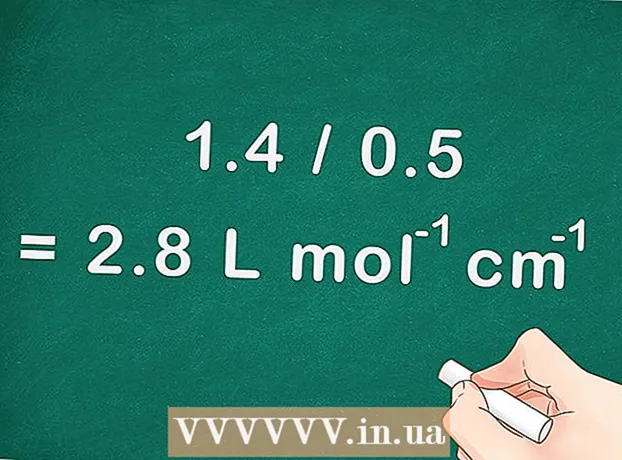
 4 Upang mahanap ang koepisyentong pagsipsip ng molar, hatiin ang slope ng isang tuwid na linya sa pamamagitan ng landas na biniyahe ng ilaw (lalim ng cuvette). Ang landas na naglakbay ng ilaw ay katumbas ng lalim ng cuvette na ginamit sa spectrophotometer.
4 Upang mahanap ang koepisyentong pagsipsip ng molar, hatiin ang slope ng isang tuwid na linya sa pamamagitan ng landas na biniyahe ng ilaw (lalim ng cuvette). Ang landas na naglakbay ng ilaw ay katumbas ng lalim ng cuvette na ginamit sa spectrophotometer. - Para sa aming halimbawa, nakukuha namin: kung ang slope ay 1.4, at ang lalim ng cuvette ay 0.5 sentimetro, kung gayon ang koepisyent ng pagsipsip ng molar ay 1.4 / 0.5 = 2.8 L mol cm.
Karagdagang mga artikulo
 Paano makalkula ang square square
Paano makalkula ang square square  Paano mahahanap ang bilang ng mga proton, neutron at electron
Paano mahahanap ang bilang ng mga proton, neutron at electron  Paano matukoy ang mga electron ng valence
Paano matukoy ang mga electron ng valence  Paano balansehin ang mga equation ng kemikal
Paano balansehin ang mga equation ng kemikal  Paano isulat ang elektronikong pagsasaayos ng isang atom ng anumang elemento
Paano isulat ang elektronikong pagsasaayos ng isang atom ng anumang elemento  Paano makalkula ang konsentrasyon ng isang solusyon
Paano makalkula ang konsentrasyon ng isang solusyon  Paano makalkula ang molarity ng isang solusyon
Paano makalkula ang molarity ng isang solusyon  Paano makahanap ng bilang ng mga neutron sa isang atom
Paano makahanap ng bilang ng mga neutron sa isang atom  Paano gumawa ng inuming tubig mula sa asin
Paano gumawa ng inuming tubig mula sa asin  Paano gamitin ang periodic table
Paano gamitin ang periodic table  Paano maiimbak ang tuyong yelo
Paano maiimbak ang tuyong yelo  Paano gumawa ng tuyong yelo
Paano gumawa ng tuyong yelo  Paano gumawa ng toothpaste ng elepante
Paano gumawa ng toothpaste ng elepante  Paano palabnawin ang solusyon
Paano palabnawin ang solusyon



