May -Akda:
Lewis Jackson
Petsa Ng Paglikha:
8 Mayo 2021
I -Update Ang Petsa:
25 Hunyo 2024

Nilalaman
Ang net ionic equation ay isang mahalagang bahagi ng kimika sapagkat ito ay kumakatawan lamang sa mga maliit na butil na nagbabago sa isang reaksyong kemikal. Kadalasan ginagamit ang mga ito sa reaksyon ng pagbabawas ng oksihenasyon, mga reaksyon ng metabolic, at reaksyon ng pagpapanatili ng mga acid - base. Mayroong tatlong pangunahing mga hakbang sa pagsulat ng isang net ionic equation: balansehin ang equation ng molekula, i-convert ito sa buong ionic equation (ayon sa kung paano umiiral ang bawat sangkap sa solusyon), at sa wakas ay isulat ang net ionic equation.
Mga hakbang
Bahagi 1 ng 2: Pag-unawa sa mga bahagi ng equation na ionic
Alamin ang pagkakaiba sa pagitan ng mga molekula at mga ionic compound. Ang unang hakbang sa pagsulat ng isang net ionic equation ay upang matukoy ang mga ionic compound sa reaksyon. Ang mga ionic compound ay ang mga pinaghiwalay ng mga ions sa isang may tubig na solusyon at mayroong singil na elektrikal. Ang mga compound ng molecular ay mga compound na hindi kailanman mayroong singil sa elektrisidad. Ang mga ito ay nabuo sa pagitan ng dalawang mga hindi metal at kung minsan ay tinutukoy bilang mga covalent compound.
- Ang mga ionic compound ay maaaring mabuo sa pagitan ng mga metal at hindi metal, metal at polyatomic ions, o maraming polyatomic ion.
- Kung hindi ka sigurado kung ano ang compound, maaari kang maghanap ng mga elemento sa compound na iyon sa periodic table.

Kilalanin ang solubility ng isang compound. Hindi lahat ng mga ionic compound ay natutunaw sa may tubig na solusyon, at samakatuwid ay hindi maaaring ihiwalay sa mga ions. Dapat mong kilalanin ang solubility ng bawat compound bago magpatuloy sa natitirang equation. Nasa ibaba ang isang buod ng mga patakaran para sa solubility. Maghanap ng isang solshellness spreadsheet para sa mas detalyadong impormasyon at mga pagbubukod sa mga patakarang ito.- Sundin ang mga patakarang ito sa pagkakasunud-sunod na nakabalangkas sa ibaba:
- Lahat ng mga asing-gamot na Na, K, at NH4 natunaw lahat.
- Lahat WALANG asin3, C2H3O2, ClO3, at ClO4 natunaw lahat.
- Lahat ng mga Ag, Pb, at Hg asing-gamot2 natunaw lahat.
- Natutunaw ang lahat ng mga asin ni Cl, Br, at ako.
- Lahat ng mga asing-gamot sa CO3, O, S, OH, PO4, CrO4, Cr2O7, at KAYA3 ay natunaw (maliban sa ilang mga kaso).
- Lahat ng KAYA asing-gamot4 ay natunaw (maliban sa ilang mga kaso).
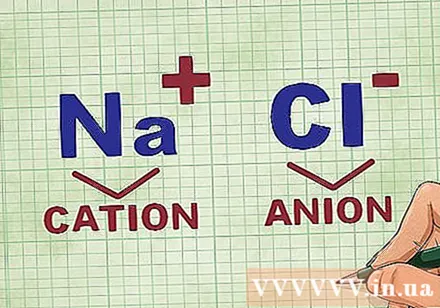
Pagtukoy ng mga cation at anion sa isang compound. Ang mga kation ay ang mga positibong ions sa isang compound at karaniwang metal. Ang anion ay ang negatibong ion sa compound at hindi metal. Ang ilang mga hindi metal ay maaaring bumuo ng mga cation, ngunit ang mga metal ay laging bumubuo ng mga cation.- Halimbawa, sa NaCl, Na ang positibong sisingilin na cation sapagkat ito ay isang metal, at si Cl ang negatibong sisingilin ng anion sapagkat ito ay hindi metal.

Kilalanin ang mga polyatomic ion sa reaksyon. Ang mga polyatomic ions ay sisingilin ng mga molekula na mahigpit na nakagapos at hindi nakakahiwalay sa mga reaksyong kemikal. Mahalagang kilalanin ang mga polyatomic ions sapagkat mayroon silang isang tiyak na pagsingil at hindi nagkakalayo. Ang mga polyatomic ion ay maaaring magkaroon ng positibo o negatibong pagsingil.- Kung nag-aaral ka ng pangkalahatang kimika, madalas na kinakailangan na tandaan ang ilang mga karaniwang polyatomic ion.
- Ang ilang mga karaniwang polyatomic ion ay CO3, HINDI3, HINDI2, KAYA4, KAYA3, ClO4 at ClO3.
- Maaari ka ring makahanap ng maraming iba pang mga ions sa mga libro ng kimika o sa internet.
Bahagi 2 ng 2: Pagsulat ng isang net ionic equation
Balansehin ang mga equation na molekular. Bago magsulat ng isang net ionic equation, dapat mong tiyakin na ang iyong molekular equation ay balanse. Upang balansehin ang equation, nagdagdag ka ng mga coefficients sa harap ng compound upang ang bilang ng atomiko ng bawat elemento ay pantay sa magkabilang panig ng equation.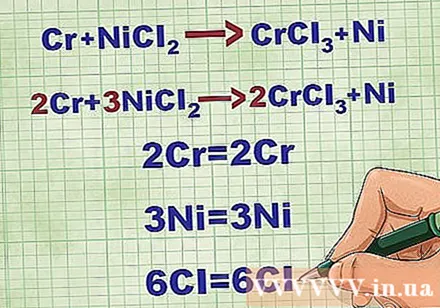
- Isulat ang bilang ng mga atomo na bumubuo sa bawat tambalan sa magkabilang panig ng equation.
- Magdagdag ng isang koepisyent sa harap ng mga elemento maliban sa oxygen at hydrogen upang balansehin ang bawat panig.
- Balanse ng hydrogen atom.
- Balanse ng oxygen ng atom.
- Ikuwento muli ang bilang ng mga atomo sa bawat panig ng equation upang matiyak na balanse ang mga ito.
- Halimbawa, ang Cr + NiCl2 -> CrCl3 + Ni Nabalanse sa 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
Kilalanin ang estado ng tambalan sa equation. Maraming beses sa problema may mga keyword na ipaalam sa iyo ang estado ng bawat compound. Mayroong maraming mga patakaran upang matulungan matukoy ang estado ng isang elemento o tambalan.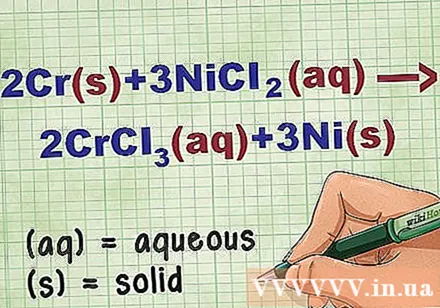
- Kung ang estado ng isang elemento ay hindi ibinigay, pagkatapos ay gamitin ang estado na matatagpuan sa pana-panahong talahanayan.
- Kung ang tambalan ay tinatawag na solusyon, maaari mo itong isulat bilang may tubig o (DD).
- Kung mayroong tubig sa equation, dapat mong matukoy kung ang ionic compound ay natutunaw ng tubig gamit ang solubility spreadsheet. Kung ang solubility ay mataas, ang compound ay magiging may tubig (DD), kung ang solubility ay mababa, ang compound ay magiging solid (r).
- Nang walang tubig, ang ionic compound ay solid (r).
- Kung ang problema ay acidic o basic, pagkatapos ang compound ay may tubig (DD).
- Halimbawa, 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Ang mga sangkap na sangkap ng Cr at Ni ay nasa solidong estado. NiCl2 at CrCl3 natutunaw ang mga ionic compound, kaya't sila ay may tubig. Isulat muli ang equation bilang: 2Cr(r) + 3NiCl2(DD) -> 2CrCl3(DD) + 3Ni(r).
Tukuyin kung aling mga compound ang maghiwalay (maghiwalay sa mga kation at anion) sa solusyon. Kapag ang isang sangkap o tambalan ay naghiwalay, naghiwalay ito sa isang positibong sisingilin na ion (cation) at isang negatibong sisingilin na ion (anion). Ito ang mga sangkap na magiging equilibrated sa dulo ng net ionic equation.
- Ang mga solido, likido, gas, mga compound ng molekula, mababang solubility ionic compound, polyatomic ions at mahina na acid ay hindi magkakahiwalay.
- Ang mga compound ng ionic ay may mataas na matutunaw (gamitin ang solubility table) at ang mga malalakas na acid ay magsis ionize ng 100% (HCl(DD), HBr(DD), HI(DD), H2KAYA4(DD), HClO4(DD), at HNO3(DD)).
- Tandaan, kahit na ang mga polyatomic ion ay hindi na hihiwalay pa, kung ang mga ito ay nasasakupan ng compound na iyon, sila ay lumayo mula sa compound.
Kalkulahin ang singil ng bawat ion na pinaghiwalay mula sa compound. Tandaan na ang mga metal ay bubuo ng mga positibong ions at ang mga hindi metal ay bubuo ng mga negatibong ions. Gamitin ang periodic table upang matukoy ang singil ng isang elemento. Dapat mo ring balansehin ang singil ng bawat ion sa compound.
- Sa halimbawang ito, NiCl2 naghiwalay sa Ni at Cl habang ang CrCl3 nahati sa Cr at Cl.
- Si Ni ay may singil na 2+ dahil may negatibong pagsingil si Cl ng isa ngunit mayroong 2 atoms. Samakatuwid, kailangan nating balansehin ang 2 negatibong Cl ion. Ang Cr ay may 3+ singil, kaya dapat balansehin natin ang 3 negatibong Cl ions.
- Tandaan na ang mga polyatomic ion ay may isang tukoy na singil.
Isulat ang kumpletong equation na ionic. Anumang bagay na dissociates o ionize (malakas na acid) naghihiwalay sa dalawang magkakahiwalay na ions. Ang estado ng sangkap ay nananatili (DD), ngunit tiyakin na ang equation ay mananatiling balanseng.
- Ang mga solido, likido, gas, mahina na asido, at mababang solubility ionic compound ay hindi binabago ang estado o hiwalay sa mga ions. Pinananatili namin silang buo.
- Ang mga sangkap na molekular ay magkakalat sa solusyon kaya't nagbago ang kanilang estado sa (DD). Tatlong mga pagbubukod hindi maging (DD) ay: CH4(k), C3H8(k), at C8H18(l).
- Pagpapatuloy sa halimbawa sa itaas, ganito ang hitsura ng buong ionic equation: 2Cr(r) + 3Ni(DD) + 6Cl(DD) -> 2Cr(DD) + 6Cl(DD) + 3Ni(r). Kapag ang Cl ay wala sa isang compound, hindi ito isang bipolar, kaya pinarami namin ang kadahilanan sa bilang ng mga atom sa compound upang makakuha ng 6 Cl ions sa magkabilang panig ng equation.
Alisin ang mga ions ng equilibrium ions sa pamamagitan ng pagkansela ng parehong mga ions sa bawat panig ng equation. Maaari mo lamang kanselahin kung pareho ang mga ito sa magkabilang panig (singil, numero ng atomic, atbp.). Isulat muli ang equation nang walang mga mapanirang sangkap.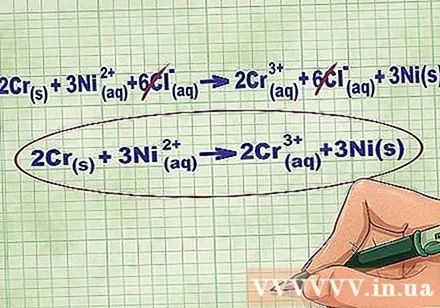
- Matapos makumpleto ang halimbawa, mayroon kaming 6 na nakanselang ions na equilibrium ng ion ng ion sa bawat panig. Ang net ionic equation ay 2Cr(r) + 3Ni(DD) -> 2Cr(DD) + 3Ni(r).
- Kung tama ka kung gayon ang kabuuang pagsingil sa panig ng reactant ay dapat na katumbas ng kabuuang pagsingil sa panig ng produkto sa net ionic equation.
Payo
- Isulat ang mga estado ng lahat ng mga sangkap sa equation, kung hindi ikaw ay mawawalan ng puntos.



